Диаметр микротрубочек. Строение микротрубочек и их функции
В клетках микротрубочки принимают участие в создании ряда временных (цитоскелет интерфазных клеток, веретено деления) или постоянных (центриоли, реснички, жгутики) структур.
Микротрубочки представляют собой прямые, неветвящиеся длинные полые цилиндры (см. рис. 18). Их внешний диаметр составляет около 24 нм, внутренний просвет имеет ширину 15 нм, а толщина стенки - 5 нм. Стенка микротрубочек построена за счет плотно уложенных округлых субъединиц диаметром около 5 нм. В электронном микроскопе на поперечных сечениях микротрубочек видны большей частью 13 субъединиц, выстроенных в виде однослойного кольца. Микротрубочки, выделенные из разных источников (реснички простейших, клетки нервной ткани, веретено деления), имеют сходный состав и содержат белки - тубулины. Практически во всех эукариотических клетках в гиалоплазме можно видеть длинные неветвящиеся микротрубочки. В больших количествах они обнаруживаются в цитоплазматических отростках нервных клеток, фибробластов и других изменяющих свою форму клеток.
Одно из функциональных значений таких микротрубочек цитоплазмы заключается в создании эластичного, но одновременно устойчивого внутриклеточного каркаса (цитоскелета), необходимого для поддержания формы клетки.
Создавая внутриклеточный скелет, микротрубочки могут быть факторами ориентированного движения клетки в целом и ее внутриклеточных компонентов, задавать своим расположением векторы для направленных потоков разных веществ и для перемещения крупных структур.
Разрушение микротрубочек колхицином нарушает транспорт веществ в аксонах нервных клеток, приводит к блокаде секреции и т.д.
9. Лизосомы: строение, функции, классификация
Лизосомы - это разнообразный класс вакуолей размером 0,2-0,4 мкм, ограниченных одиночной мембраной. Характерным признаком лизосом является наличие в них гидролитических ферментов - гидролаз (протеиназы, нуклеазы. глюкозидазы, фосфатазы, липазы), расщепляющих различные биополимеры при кислом рН. Лизосомы были открыты в 1949 г. де Дювом.
Среди лизосом можно выделить по крайней мере 3 типа: первичные лизосомы, вторичные лизосомы (фаголизосомы и аутофагосомы) и остаточные тельца. Разнообразие морфологии лизосом объясняется тем, что эти частицы участвуют в процессах внутриклеточного переваривания, образуя сложные пищеварительные вакуоли как экзогенного (внеклеточного), так и эндогенного (внутриклеточного) происхождения.
Первичные лизосомы представляют собой мелкие мембранные пузырьки размером около 0,2-0,5 мкм, заполненные бесструктурным веществом, содержащим гидролазы, в том числе активную кислую фосфатазу, которая является маркерным для лизосом ферментом. Эти мелкие пузырьки практически очень трудно отличить от мелких везикул на периферии зоны аппарата Гольджи, которые также содержат кислую фосфатазу. Местом ее синтеза является гранулярная эндоплазматическая сеть.
Вторичные лизосомы, или внутриклеточные пищеварительные вакуоли, формируются при слиянии первичных лизосом с фагоцитарными или пиноцитозными вакуолями, образуя фаголизосомы, или гетерофагосомы, а также с измененными органеллами самой клетки, подвергающимися перевариванию (аутофагосомы). Вещества, попавшие в состав вторичной лизосомы, расщепляются гидролазами до мономеров, которые транспортируются через мембрану лизосомы в гиалоплазму, где они реутилизируются, т.е. включаются в различные обменные процессы.
Однако расщепление, переваривание биогенных макромолекул внутри лизосом может идти в ряде клеток не до конца. В этом случае в полостях лизосом накапливаются непереваренные продукты. Такая лизосома носит название «телолизосома», или остаточное тельце. Остаточные тельца содержат меньше гидролитических ферментов, в них происходит уплотнение содержимого, его перестройка. Например, у человека при старении организма в клетках мозга, печени и в мышечных волокнах в телолизосомах происходит отложение «пигмента старения» - липофусцина.
Практически во всех эукариотических клетках в гиалоплазме можно видеть длинные неветвящиеся микротрубочки . В больших количествах они обнаруживаются в цитоплазматических отростках нервных клеток, фибробластов и других изменяющих свою форму клеток. Они могут быть выделены сами или можно выделить образующие их белки: это те же тубулины со всеми их свойствами.
Главное функциональное значение таких микротрубочек цитоплазмы заключается в создании эластичного, но одновременно устойчивого внутриклеточного каркаса (цитоскелета), необходимого для поддержания формы клетки.
К органеллам немембранного строения относят микротрубочки - трубчатой формы образования различной длины с внешним диаметром 24 нм, толщиной стенки около 5 нм и шириной «просвета» 15 нм. Они встречаются в свободном состоянии в цитоплазме клеток или как структурные элементы жгутиков (сперматозоиды), ресничек (мерцательный эпителий трахеи), митотического веретена и центриолей (делящиеся клетки).
Микротрубочки строятся путем сборки (полимеризации) белка тубулина. Микротрубочки полярны: в них выделяют концы (+) и (-). Их рост происходит от специальной структуры неделящихся клеток - центра организации микротрубочек , с которым органелла связана концом (-) и который представлен двумя элементами, идентичными по строению центриолям клеточного центра. Удлинение микротрубочек происходит путем присоединения новых субъединиц на конце (+). В начальной фазе направление роста не определено, но из образующихся микротрубочек сохраняются те, которые вступают в контакт своим (+) концом с подходящей мишенью. В растительных клетках, в которых микротрубочки имеются, структур типа центриолей не найдено.
Микротрубочки принимают участие:
- в поддержании формы клеток,
- в организации их двигательной активности (жгутики, реснички) и внутриклеточных транспортов (хромосомы в анафазе митоза).
Функции внутриклеточных молекулярных двигателей выполняют белки кинезин и динеин, имеющие активность фермента АТФ-азы. При жгутиковом или реснитчатом движении молекулы динеина, прикрепляясь к микротрубочкам и используя энергию АТФ, перемещаются по их поверхности по направлению к базальному тельцу, то есть к концу (-). Смещение микротрубочек друг относительно друга вызывает волнообразные движения жгутика или ресничек, побуждающие клетку к перемещению в пространстве. В случае неподвижных клеток, например, реснитчатого эпителия трахеи, описанный механизм используется для выведения из дыхательных путей слизи с оседающими в ней частицами (дренажная функция).
Участие микротрубочек в организации внутриклеточных транспортов иллюстрирует перемещение в цитоплазме пузырьков (везикул). Молекулы кинезина и динеина содержат две глобулярных «головки» и «хвосты» в виде белковых цепей. При помощи головок белки контактируют с микротрубочками, перемещаясь по их поверхности: кинезин от конца (-) к концу (+), а динеин в противоположном направлении. При этом они тянут за собой пузырьки, прикрепленные к «хвостам». Предположительно, макромолекулярная организация «хвостов» вариабельна, чем обеспечивается узнавание различных транспортируемых структур.
С микротрубочками как обязательным компонентом митотического аппарата связывают расхождение центриолей к полюсам делящейся клетки и перемещение хромосом в анафазе митоза. Для животных клеток, клеток части растений, грибов и водорослей характерен клеточный центр (диплосома), образованный двумя центриолями . Под электронным микроскопом центриоль имеет вид «полого» цилиндра диаметром 150 нм и длиной 300-500 нм. Стенка цилиндра образована 27 микротрубочками, сгруппированными в 9 триплетов. В функцию центриолей, сходных по структуре с элементами центра организации микротрубочек (см. здесь же, выше), входит образование нитей митотического веретена (веретена деления, ахроматинового веретена классической цитологии), представляющих собой микротрубочки. Центриоли поляризуют процесс деления клетки, обеспечивая закономерное расхождение к ее полюсам сестринских хроматид (дочерних хромосом) в анафазе митоза
Структура кинезина (а) и транспорт везикулы по микротрубочке (б)
Вокруг каждой центриоли расположен бесструктурный, или тонковолокнистый, матрикс. Часто можно обнаружить несколько дополнительных структур, связанных с центриолями: спутники (сателлиты), фокусы схождения микротрубочек, дополнительные микротрубочки, образующие особую зону, центросферу вокруг центриоли.
|
Никита Борисович Гудимчук — кандидат физико-математических наук, старший научный сотрудник Центра теоретических проблем физико-химической фармакологии РАН и Детского центра гематологии, онкологии и иммунологии им. Дмитрия Рогачева. Область научных интересов — теоретическое и экспериментальное исследование механизмов деления клетки и динамики микротрубочек. |
Павел Николаевич Захаров — младший научный сотрудник лаборатории биофизики Детского центра гематологии, онкологии и иммунологии. Занимается математическим моделированием митотического деления клетки. |
Евгений Владимирович Ульянов — аспирант физического факультета Московского государственного университета им. М. В. Ломоносова. Область научных исследований — компьютерное моделирование динамики микротрубочек. |
Фазоил Иноятович Атауллаханов — доктор биологических наук, профессор МГУ, директор Центра теоретических проблем физико-химической фармакологии, заведующий лабораторией биофизики Детского центра гематологии, онкологии и иммунологии. Научные интересы — клеточная биология, нелинейная динамика и самоорганизация в биологических системах. |
Микротрубочки - один из трех основных типов белковых нитей клетки. Вместе с актиновыми и промежуточными филаментами они образуют клеточный каркас - цитоскелет. Благодаря своим уникальным механическим свойствам микротрубочки выполняют целый ряд ключевых функций на всех этапах жизни клетки, в том числе помогают организовать ее содержимое и служат «рельсами» для направленного транспорта внутриклеточных «грузов» - везикул и органелл. Микротрубочки - динамические структуры, они постоянно меняют свою длину за счет роста или укорачивания. Такое поведение, называемое динамической нестабильностью, существенно влияет на различные внутриклеточные процессы. Например, если клетка выпячивает часть цитоплазмы во время амебоидного движения, микротрубочки быстро заполняют новый объем, повышая в нем интенсивность внутриклеточного транспорта. Часть этих филаментов избирательно стабилизируется, тем самым задавая направление, вдоль которого перемещение «грузов» происходит более регулярно. Вдоль выделенной линии активизируются внутриклеточные процессы, а значит, создаются условия для возникновения у клетки полярности. Главенствующую роль динамика микротрубочек играет во время клеточного деления. Их способность менять длину интенсивно исследуется уже более 30 лет, однако механизмы, лежащие в основе этого феномена, все еще плохо изучены.
Строение и свойства микротрубочек

Микротрубочки - это линейные полимеры. Они построены из димеров белка тубулина, которые образуют 13 цепей - протофиламентов (рис. 1). Каждый из них по бокам связан с двумя другими, и вся конструкция замкнута в цилиндр диаметром 25 нм. Такое строение обеспечивает микротрубочке прочность и большую изгибную жесткость: она может оставаться почти абсолютно прямой в масштабе клетки. Чтобы представить, насколько микротрубочка сложно сгибаема, мысленно увеличим ее до размеров стержня диаметром спагетти (около 2 мм). Такая «спица» не прогибалась бы, будь она длиной даже в сотни метров (высота современных небоскребов)! Жесткость позволяет микротрубочкам выполнять роль длинных прямых направляющих, которые организуют движение органелл внутри клетки. Остальные элементы цитоскелета (актиновые и промежуточные филаменты) существенно более гибкие, поэтому, как правило, используются клеткой в других целях.
Димер тубулина, из которого строится микротрубочка, состоит из мономеров двух типов. Внутри каждого протофиламента α-мономеры одного димера соединяются с β-мономерами соседнего. Поэтому по всей длине микротрубочки, содержащей десятки и сотни тысяч димеров тубулина, все они ориентированы одинаково. Тот конец микротрубочки, к которому обращены α-тубулины, называется минус-концом, а противоположный - плюс-концом. Благодаря такому упорядоченному расположению димеров микротрубочка имеет полярность, что обеспечивает направленность транспорта. Моторные белки, которые участвуют в перемещении «грузов» из одной части клетки в другую, «шагают» по микротрубочке, перетаскивая свою «ношу» за собой, как правило, только в одном направлении. Например, белок динеин двигает органеллы к минус-концу микротрубочки, а кинезин - к плюс-концу. Часто микротрубочки расположены в клетке радиально, а их плюс-концы направлены к ее периферии. Таким образом, кинезины осуществляют транспортировку из центра к внешней мембране, а динеины - от нее внутрь клетки. Поразительно, но в отростках аксонов везикулы и органеллы могут направленно передвигаться по микротрубочкам на расстояния в сотни микрометров и больше.
Динамическая нестабильность: в клетках и в пробирке
От обычных биополимеров микротрубочки отличаются не только механическими свойствами, но и уникальным динамическим поведением (рис. 2). Обычный полимер растет монотонно до тех пор, пока скорость присоединения новых субъединиц из раствора не сравняется со скоростью отделения уже прикрепленных. Полимеризация же микротрубочки носит колебательный характер. Ее длина попеременно то увеличивается, то уменьшается при фиксированной концентрации димеров тубулина в растворе. В одних и тех же условиях сосуществуют растущие и укорачивающиеся микротрубочки. Переходы от стадии роста к укорочению называют катастрофами, а обратные - спасениями. Впервые такое поведение - динамическую нестабильность - обнаружили Т. Митчисон (T. Mitchison) и М. Киршнер (M. Kirschner) около 30 лет назад .
Динамическая нестабильность микротрубочек особенно важна во время митоза. Из них строится специальный аппарат для разделения клетки - веретено деления. Оно центрируется благодаря микротрубочкам, которые отталкиваются от клеточной мембраны. Далее, удлиняясь и укорачиваясь, они «обыскивают» пространство клетки в поисках хромосом. Отыскав их и закрепившись за них своими концами, микротрубочки развивают тянущие и толкающие силы, перемещая хромосомы к экватору клетки. Четко выстроив на нем генетический материал и тем самым обеспечив готовность клетки к разделению, микротрубочки растаскивают хромосомы к клеточным полюсам. Все это происходит благодаря динамической нестабильности микротрубочек. Незаменимая роль динамики микротрубочек в митозе привела к разработке лекарств от онкологических заболеваний. Так, например, низкомолекулярное вещество таксол - известный противоопухолевый препарат, стабилизирующий микротрубочки, а значит, останавливающий деление раковых клеток.
Нестабильность микротрубочек проявляется не только в клетках, но и в пробирке - в растворе образующего их белка. Следовательно, для проявления ими этого свойства не требуется ничего, кроме тубулина. Он присоединяется из раствора к концу микротрубочки во время фазы ее роста или, наоборот, отделяется и уходит обратно в раствор во время стадии укорачивания. Тем не менее, другие клеточные белки могут влиять на параметры динамической нестабильности, например, ускорять рост микротрубочек в клетках, менять (увеличивать или уменьшать) частоты катастроф и спасений. Известно, что в пробирке скорость роста микротрубочек и эти частоты многократно ниже, чем в клетках при той же концентрации тубулина.
Модель ГТФ-«шапочки»
Почему микротрубочки, в отличие от других биополимеров, динамически нестабильны? Рост микротрубочки, как сказано, происходит благодаря присоединению к ее концу димеров тубулина. Каждый мономер этого белка связан с молекулой гуанозинтрифосфата (ГТФ). Однако вскоре после присоединения тубулина к микротрубочке молекула ГТФ, связанная с β-субъединицей, гидролизуется до гуанозиндифосфата (ГДФ). ГТФ-димеры тубулина в составе протофиламента стремятся вытянуться, образовать линейную структуру, а ГДФ-димеры - изогнуться в рожок с радиусом кривизны около 20 нм. За счет постоянного присоединения ГТФ-димеров микротрубочка удлиняется, а на ее конце формируется «пояс» из молекул, еще не успевших гидролизовать ГТФ. Пытаясь выпрямиться, этот слой - ГТФ-«колпачок» (или «шапочка») - не дает выгнуться наружу нижележащим ГДФ-димерам и таким образом предохраняет растущий конец микротрубочки от разборки. Считается, что микротрубочка устойчиво растет и защищена от катастрофы, пока на ее конце есть ГТФ-«шапочка». Исчезновение последней в результате гидролиза или случайного отделения ГТФ-димеров тубулина переводит микротрубочку в фазу укорочения.
Модель ГТФ-«шапочки» появилась практически сразу после открытия динамической нестабильности и покорила исследователей своей простотой и элегантностью. Получено уже довольно много экспериментальных фактов, подтверждающих эту модель. Один из классических опытов, показывающих, что на конце микротрубочки есть некая стабилизирующая структура, заключается в следующем. Растущую микротрубочку перерезают микроиглой или сфокусированным пучком ультрафиолетового света [ , ]. Плюс-конец с отрезанной стороны немедленно начинает разбираться. Интересно, что минус-конец со стороны разреза обычно не разбирается, а продолжает расти. Р. Никлас (R. Nicklas) делал похожий опыт, но разрезал с помощью микроиглы микротрубочку в митотическом веретене внутри клетки . Как и в предыдущем случае, микротрубочка тут же разбиралась со стороны разреза на плюс-конце и оставалась стабильной на минус-конце. Поведение последнего до сих пор остается загадкой, но результаты этих экспериментов сочли сильным доводом, подтверждающим наличие на растущем плюс-конце микротрубочки стабилизирующей ГТФ-«шапочки».
Другой важный аргумент в пользу этой модели появился, когда создали химически модифицированный ГТФ - очень похожий на свой прообраз, но практически неспособный к гидролизу. Когда в растворе плавают только такие молекулы, микротрубочки хорошо растут, но никогда не испытывают катастрофы . Такое поведение подтверждает гипотезу о ГТФ-«шапочке»: ее слабогидролизуемый аналог никак не меняется со временем, а значит, не позволяет микротрубочке разбираться.
Косвенных доказательств существования ГТФ-«шапочки» много, однако ее до сих пор не удалось напрямую увидеть (хотя такие попытки предпринимались). По крайней мере, оценили размер минимальной структуры из слабогидролизуемого аналога ГТФ, которой достаточно, чтобы стабилизировать рост микротрубочки. Защитить ее от разборки, как оказалось, может «шапочка» всего в один слой димеров (при этом реально она может быть и толще). Наглядный способ оценить количество ГТФ-димеров на конце растущей микротрубочки - добавить белок с флуоресцентной меткой, который их распознает. Так называемый плюс-концевой белок EB1 in vitro светится на расстоянии порядка сотни слоев тубулина, причем интенсивность флуоресценции падает от конца к телу микротрубочки. Если этот белок действительно предпочитает связываться именно с ГТФ-димерами, то подобное распределение свечения указывает на то, что ГТФ-«шапочка» может быть значительно больше одного слоя. Примечательно, что белок ЕВ1 ярко окрашивает концы растущих микротрубочек, но начинает гаснуть за несколько секунд перед переходом филамента к катастрофе, как будто отражая постепенное исчезновение стабилизирующей ГТФ-«шапочки» . Измеренная интенсивность флуоресценции белка EB1 на концах микротрубочек в живых клетках также свидетельствует в пользу большой (существенно толще одного слоя тубулинов) ГТФ-«шапочки» . Кроме мечения микротрубочек белком EB1, «шапочку» также визуализировали в клетках с помощью специальных антител, узнающих ГТФ-тубулин . Интересно, что они связывались не только с концами микротрубочек, но и образовывали «островки» на остальной поверхности.
Микротрубочки стареют?
Модель ГТФ-«шапочки» привлекла внимание исследователей прежде всего потому, что позволила объяснить, почему микротрубочка может устойчиво расти и укорачиваться и почему между этими фазами возможны переходы - катастрофы и спасения.
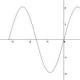
В 1995 г. Д. Одде (D. Odde) с соавторами провел простой, но важный эксперимент . Они наблюдали за ростом микротрубочек в пробирке и решили построить распределение их длин. Оно предполагалось экспоненциальным, но оказалось, что у него есть пик (рис. 3). Значит, в начале роста микротрубочки имеют очень маленькую вероятность испытать катастрофу, а дальше, по мере их роста, эта вероятность повышается. Если пересчитать распределение длин микротрубочек в частоты катастроф, то получится возрастающая зависимость частоты катастроф от времени. Этот эффект назвали «старением» микротрубочек - они как будто «портятся» со временем. Иначе говоря, «молодые» микротрубочки могут расти стабильно, а «старые» уже более склонны к разборке. Необычное распределение времен жизни микротрубочек хорошо аппроксимируется гамма-распределением, которое характеризует процессы с фиксированным количеством последовательных шагов. Поэтому возникла идея, что лучше всего результаты проведенного эксперимента описывает теория, согласно которой катастрофа микротрубочки происходит за три последовательных стадии, когда в ней накопились определенные дефекты неизвестной природы . Эта гипотеза, исходно достаточно сомнительная, тем не менее существенно подогрела интерес к исследованию динамики микротрубочек на уровне отдельных димеров тубулина.

Чего пока не может эксперимент и как помогает теория?
Обнаруженный феномен «старения» микротрубочек показал, что общепринятая, ставшая классической, модель ГТФ-«шапочки» - некоторое упрощение. Действительно, она только постулирует, что микротрубочка испытывает катастрофу, когда теряет свой стабилизирующий «колпачок», но не объясняет, как и почему это происходит, а также из-за чего же вообще микротрубочка может «стареть». Что за таинственные дефекты накапливаются внутри «стареющей» микротрубочки, приводя ее к катастрофе? Сколько их и в какой последовательности они должны проявляться? Может быть, речь идет о гидролизе отдельных молекул ГТФ внутри «шапочки» или о каком-то другом процессе, зависящем от не установленных пока событий совсем иной природы?
Естественно, исследователи хотели бы как можно тщательнее разглядеть «живые» микротрубочки, чтобы ответить на эти вопросы. Однако современный экспериментальный арсенал не позволяет это сделать. Мы можем или увидеть замороженную (обездвиженную) микротрубочку с нанометровым разрешением, например, с помощью электронного микроскопа, или проследить динамику микротрубочки со скоростью сотни кадров в секунду под оптическим микроскопом. К сожалению, невозможно получить соответствующие данные одновременно, чтобы четко их соотнести. Во многом по вине таких ограничений современной науке неизвестно, каков точный размер ГТФ-«шапочки» и как он меняется со временем, а также какую форму имеют концы микротрубочек и как она определяет их динамику.
На помощь экспериментам приходят теоретические методы исследования, в частности компьютерное моделирование. Оно может воссоздать микротрубочку с очень высоким пространственно-временным разрешением, правда, ценой неизбежных идеализаций и упрощений, адекватность которых нужно тщательно проверять (сравнивая результаты модельного и настоящего экспериментов). Идеальная компьютерная модель должна описывать все имеющиеся экспериментальные данные. Тогда на ее основе можно будет изучить механизмы наблюдаемого поведения микротрубочек и предсказать принцип действия белков, влияющих на динамику этих филаментов в клетках. Также станет возможным подбор химических соединений для управления поведением микротрубочек в медицинских целях.
На сегодняшний день создано множество моделей микротрубочек - от очень простых до весьма сложных. Самыми лучшими оказались наиболее детальные модели - молекулярные, которые учитывают, что микротрубочка состоит из многих протофиламентов и что ее структура дискретна (совокупность отдельных субъединиц - тубулинов). Первые такие модели стали появляться почти сразу после обнаружения динамической нестабильности в 1984 г. Работая с ансамблем взаимодействующих тубулинов, они воссоздают поведение микротрубочки как целого. Со времен первых молекулярных моделей накопилось много новых экспериментальных данных о микротрубочках. С тех пор уточнили их строение, измерили новые зависимости характеристик роста и укорочения от различных параметров, изучили поведение этих филаментов после разбавления тубулина, оценили размер ГТФ-«шапочки», открыли способность концов микротрубочек развивать тянущие и толкающие силы [11–19 ] . Это позволяло корректировать расчеты и все точнее задавать параметры взаимодействия тубулинов. Однако росли и требования к моделям, поскольку они должны непротиворечиво описывать весь набор имеющихся экспериментальных результатов. Таким образом, способы описания взаимодействия тубулинов совершенствовались и усложнялись. От простых моделей, где субъединицы либо взаимодействуют друг с другом, либо нет, перешли к так называемым молекулярно-механическим (самым современным и наиболее реалистичным). Они рассматривают молекулы тубулина как физические объекты, подчиняющиеся законам механики и движущиеся в поле тепловых соударений и потенциалов притяжения друг к другу [20–22 ] . В ранних молекулярно-механических расчетах динамики микротрубочек из-за ограниченной производительности компьютеров нельзя было подробно описать взаимодействие тубулинов на основе уравнений движения и с учетом тепловых колебаний. Однако эта цель оставалась очень притягательной для нашей команды, поскольку мы предполагали, что тепловые флуктуации играют существенную роль в динамике микротрубочек.
Новая молекулярно-механическая модель
Ускорения расчетов нам удалось достичь главным образом за счет технологии параллельных вычислений на крупнейшем суперкомпьютере «Ломоносов» (в вычислительном центре МГУ) . Он способен производить 1,7·10 15 операций в секунду, что выводит его на первое место в Восточной Европе по производительности.

В рамках нашей новой модели субъединицы тубулина - это шарики, на поверхности которых размещены центры взаимодействий с «соседями» (рис. 4). Рассматриваются два типа взаимодействий - продольные и боковые. Сами шарики могут существовать в двух состояниях, соответствующих ГТФ- и ГДФ-формам. В первом случае центры шариков стремятся выстроиться вдоль прямой, а во втором - вдоль дуги, соответствующей углу 22° (для каждой пары субъединиц). Центры взаимодействия притягиваются на близких расстояниях и перестают «чувствовать» друг друга на больших. Движения шариков описываются уравнениями Ланжевена (следствиями второго закона Ньютона), в которых мы пренебрегаем членами, содержащими ускорения частиц (так как эти слагаемые малы по сравнению с остальными). Субъединицы тубулина, удалившиеся от микротрубочки на расстояние, где они перестают с ней взаимодействовать, исключаются из рассмотрения. Также в систему периодически с некоторой вероятностью вводятся новые ГТФ-тубулины, которые появляются в случайной позиции на конце микротрубочки. Внутри нее они могут с определенной вероятностью подвергаться гидролизу - превращаться в ГДФ-субъединицы, которые тут же хотят расположиться по дуге, т. е. сформировать изогнутый протофиламент. Но последний необязательно сразу изгибается, так как от этого его могут удерживать боковые связи. Полученная таким образом система взаимодействующих тубулинов эволюционирует во времени: микротрубочка растет, испытывает катастрофу, укорачивается, спасается и вновь удлиняется. При этом наша модель хорошо описывает характерные формы концов растущей и укорачивающейся микротрубочек, воспроизводит наблюдаемые в экспериментах зависимости динамических характеристик от концентрации тубулина в растворе, а также феномен «старения» микротрубочек. Итак, с помощью моделирования, исходя из простых и понятных принципов и без каких-либо экзотических допущений, мы получили на экране компьютера виртуальную микротрубочку - объект, обладающий всеми основными свойствами своего реального прототипа. Рассчитав координаты всех субъединиц микротрубочки, мы можем с беспрецедентными разрешением и достоверностью узнать все о каждом элементе модельной микротрубочки в любой момент времени. Остается только проанализировать сложную последовательность событий в жизни микротрубочки и понять, какие из них и как приводят ее к переключению от роста к укорачиванию.
Что же происходит с микротрубочкой перед катастрофой? Сначала мы выяснили, выполняется ли в нашей модели какой-либо из двух ранее предложенных гипотетических сценариев этого события. Согласно одному из них, в структуре микротрубочки по мере ее роста могут возникать и сохраняться дефекты, например «дырки» в стенке, возникающие из-за того, что один из протофиламентов замедляет или прекращает свой рост (рис. 5, а ) . В нашей модели нет никаких искусственно вложенных оснований для приостановки роста отдельных протофиламентов. Поэтому такая ситуация практически никогда не реализуется, а следовательно, не может быть объяснением механизма «старения» микротрубочек и возникновения катастроф. Вторая гипотеза гласит, что увеличение склонности микротрубочки испытывать катастрофы («старение») происходит по мере постепенного заострения ее конца (рис. 5, б ) . Мы тщательно изучили разброс длин у протофиламентов микротрубочки в нашей модели и выяснили, что он быстро достигает некоей устойчивой формы, после чего микротрубочка остается с этим уровнем заостренности. Даже если искусственно создать конфигурацию микротрубочки с концом, в котором длины отдельных протофиламентов будут сильно различаться, то довольно скоро растущая белковая нить, предоставленная сама себе, достигнет все того же устойчивого уровня заостренности, к которому она обычно стремится. Таким образом, медленное заострение конца растущей микротрубочки тоже не может объяснить феномен ее «старения» в нашей модели. Мы также обратили внимание, что и размер ГТФ-«шапочки» не имеет тенденции постепенно уменьшаться (хотя существенно колеблется во время роста микротрубочки), а значит, он не может быть причиной катастрофы.

Отсутствие явного кандидата на медленный необратимый дестабилизирующий процесс привело нас к мысли, что, возможно, его и вовсе нет. А катастрофа происходит не в результате медленного накопления каких-либо дефектов, а из-за возникновения множества короткоживущих обратимых событий. Они время от времени накапливаются на конце микротрубочки и тогда приводят ее к катастрофе (рис. 5, в ). Наиболее вероятное событие, приводящее к дестабилизации микротрубочки, - возникновение изогнутого «рожка» на ее конце. Действительно, если протофиламент отогнулся, то даже в случае присоединения к его концу новых субъединиц тубулина из раствора микротрубочка не становится более стабильной и продолжает укорачиваться. Однако один изогнутый протофиламент может легко обломиться и отделиться от микротрубочки. Поэтому по-настоящему дестабилизирующий эффект будут оказывать только несколько изогнутых протофиламентов, образовавшихся на конце микротрубочки одновременно. Количество непрямых протофиламентов, возникающих незадолго до катастрофы в наших расчетах, подтверждает этот вывод.
Таким образом, компьютерное моделирование позволило пролить свет на механизм возникновения катастроф. Оказалось, что в этом процессе важную роль играет не только число ГТФ-димеров, но и механические конфигурации протофиламентов. Катастрофа - результат единовременного образования множества обратимых короткоживущих событий (изогнутых протофиламентов) на конце микротрубочки. Это дополняет классическую модель ГТФ-«шапочки» недостающими деталями, объясняя, как и почему может происходить катастрофа микротрубочки. Мы надеемся, что компьютерное моделирование со временем позволит ответить и на другие вопросы о динамике этих филаментов. Каков механизм спасения микротрубочек? Почему их плюс- и минус-концы в экспериментах по перерезанию пучком ультрафиолетового света или микроиглой ведут себя по-разному? Как белки-модуляторы и потенциальные лекарства воздействуют на динамику микротрубочек?
Клеточный центр состоит из двух центриолей и центросферы. Основу центриоли составляют девять триплетов микротрубочек, расположенных по окружности и формирующих полый цилиндр. Диаметр цилиндра центриоли составляет около 0,15-0,2 мкм, длина - от 0,3 до 0,5 мкм. Одна из микротрубочек каждого триплета (микротрубочка А) состоит из 13 протофиламентов, две другие (В и С) редуцированы и содержат по 11 протофиламентов. Все микротрубочки триплета плотно прилежат друг к другу. Каждый триплет по отношению к радиусу формируемого ими цилиндра микротрубочки располагается под углом около 40 градусов. В составе центриоли микротрубочки связаны поперечными белковыми мостиками, или ручками. Последние отходят от А-микротрубоч-ки и одним концом обращены в сторону центра центриоли, другим - к С-микротрубочке соседнего триплета.
Каждый триплет центриоли с внешней стороны связан с белковыми тельцами шаровидной формы - сателлитами, от которых в гиалоплазму расходятся микротрубочки, формирующие центросферу. Вокруг каждой центриоли обнаруживается тонковолокнистый матрикс, а сами триплеты погружены в аморфный материал умеренной электронной плотности, называемый муфтой центриоли.
В интерфазной клетке присутствует пара (дочерняя и материнская) центриолей, или диплосома, которая чаще располагается вблизи комплекса Гольджи рядом с ядром. В диплосоме продольная ось дочерней центриоли направлена перпендикулярно продольной оси материнской. Дочерняя центриоль в отличие от материнской не имеет перицентриолярных сателлитов и центросферы.
Центриоли выполняют в клетке функции организации сети цитоплазматических микротрубочек (как в покоящихся, так и делящихся клетках), а также образуют микротрубочки для ресничек специализированных клеток.
Микротрубочки присутствуют во всех животных клетках за исключением эритроцитов. Они образованы полимеризованными молекулами белка тубулина, который представляет собой гетеродимер, состоящий из двух субъединиц - альфа- и бета-тубулина. При полимеризации альфа-субъединица одного белка соединяется с бета-субъединицей следующего. Так формируются отдельные протофиламенты, которые, объединяясь по 13, формируют полую микротрубочку, внешний диаметр которой составляет около 25 нм, а внутренний - 15 нм.
Каждая микротрубочка имеет растущий плюс-конец и медленно-растущий минус-конец. Микротрубочки - один из наиболее динамичных элементов цитоскелета. Во время наращивания длины микротрубочки присоединение тубулинов происходит на растущем плюс-конце. Разборка микротрубочек наиболее часто происходит с обоих концов. Белок тубулин, формирующий микротрубочки, не является сократительным белком, и микротрубочки не наделены способностью к сокращению и передвижению. Однако микротрубочки цитоскелета принимают активное участие в транспорте клеточных органелл, секреторных пузырьков и вакуолей. Из препаратов микротрубочек отростков нейронов (аксонов) были выделены два белка - кинезин и динеин. Одним концом молекулы этих белков ассоциированы с микротрубочкой, другим - способны связываться с мембранами органелл и внутриклеточных везикул. С помощью кинезина осуществляется внутриклеточный транспорт к плюс-концу микротрубочки, а с помощью динеина - в обратном направлении.
Реснички и жгутики являются производными микротрубочек в клетках эпителия воздуховодных путей, женского полового тракта, семявыносяших путей, сперматозоидах.
Ресничка представляет собой тонкий цилиндр с постоянным диаметром около 300 нм. Это вырост плазмолеммы (аксолемма), внутреннее содержимое которого - аксонема - состоит из комплекса микротрубочек и небольшого количества гиалоплазмы. Нижняя часть реснички погружена в гиалоплазму и образована базальным тельцем. Микротрубочки располагаются по окружности реснички парами (дуплетами), повернутыми по отношению к ее радиусу под небольшим углом - около 10 градусов. В центре аксонемы расположена центральная пара микротрубочек. Формула микротрубочек в ресничке описывается как (9х2)+2. В каждом дуплете одна микротрубочка (А) является полной, т. е. состоит из 13 субъединиц, вторая (В) - неполной, т. е. содержит только 11 субъединиц. А-микротрубочка имеет динеиновые ручки, направленные к В-микротрубочке соседнего дуплета. С помощью нектин-связывающего белка микротрубочка А соединяется с микротрубочкой В соседнего дуплета. От А-микротрубочки к центру аксонемы отходит радиальная связка, или спица, которая оканчивается головкой на так называемой центральной муфте. Последняя окружает центральную пару микротрубочек. Центральные микротрубочки в отличие от периферических дуплетов микротрубочек располагаются отдельно друг от друга на расстоянии около 25 нм.
Базальное тельце реснички состоит из 9 триплетов микротрубочек. А- и В-микротрубочки триплетов базального тельца, продолжаясь в А- и В-микротрубочки дуплетов аксонемы, составляют вместе с ними единую структуру.
Реснички не содержат в своем составе сократительных белков, но при этом совершают однонаправленные биения, не изменяя своей длины. Это происходит за счет смещения пар микротрубочек относительно друг друга (продольного скольжения дуплетов) в присутствии АТФ.
Микротрубочки состоят из 13 параллельных тубулиновых протофиламентов (нитей), образующих полые цилиндры диаметром 25 нм и длиной в несколько микрометров. Каждая нить собрана из гетеродимерного белка тубулина, состоящего из двух глобулярных субъединиц – α- и β-тубулина. Сборка микротрубочек осуществляется в т.н. центре организации микротрубочек в центросоме. Микротрубочки – динамичные структуры, постоянно подвергающиеся полимеризации и деполимеризации.
Полимеризация и деполимеризация микротрубочек . Удлинение (рост) микротрубочек происходит за счет полимеризации молекул тубулина. В каждой микротрубочке различают (+)-конец и (-)-конец. Микротрубочки постоянно подвергаются полимеризации и деполимеризации с (+)-конца, тогда как с противоположного (-)-конца (если он не занят стабилизирующим белком) тубулиновые гетеродимеры отделяются от микротрубочек. Как только прекращается добавление новых диаметров к растущему концу, в этом мемте сразу начинается разборка полимера. Повторяющиеся раунды полимеризации и деполимеризации характеризуют динамическую нестабильность микротрубочек. Цитозольные белки, способные связываться с концами микротрубочек и стабилизировать их, относят к семейству ассоциированных с микротрубочками белков.
Функции микротрубочек. Микротрубочки участвуют в поддержании формы клетки, антероградном и ретроградном аксоном транспорте макромолекул, органелл и секреторных везикул, фагоцитозе и функции лизосом. Микротрубочки образуют аксонемы и базальные тельца, обеспечивая подвижность жгутиков и ресничек, в составе центриолей они обеспечивают расхождения хромосом при делении клеток.
Молекулярные моторы . Применительно к микротрубочкам под этим термином понимают АТФазы (динеины и кинезины), одним доменом связывающиеся с тубулином микротрубочек, а другим – с различными мембранными органеллами (митохондриями, секреторными везикулами из комплекса Гольджи, элементами эндоплазматической сети, эндоцитозными пузырьками, аутофагосомами) или макромолекулами. За счет расщепления АТФ моторные белки перемещаются вдоль микротрубочек и таким образом транспортируют ассоциированные с ними органеллы и макромолекулы. При этом кинезиновый мотор направлен к (+)-концу, а динеиновый – к (-)-концу микротрубочки.
Тубулин-кинезиновый хемомеханический преобразователь обеспечивает внутриклеточный транспорт органелл и перемещение хромосом вдоль микротрубочек в ходе клеточного деления. Перемещение органелл вдоль микротрубочек с участием кинезинов осуществляется в направлении (+)-конца микротрубочек.
Тубулин-динеиновый хемомеханический преобразователь отвечает за направленный транспорт макромолекул и органелл к (-)-концу микротрубочек. В составе аксонемы тубулиновый молекулярный мотор приводит в движение жгутик сперматозоида и реснички мерцательных клеток.
Аксонема состоит из 9 периферических пар микротрубочек и двух расположенных центрально одиночных микротрубочек. В каждой периферической паре различают субфириллу А, содержащую 10-11 тубулинвоых протофиламентов, и субфибриллу В, содержащую 13 протофиламентов. Смежные пары микротрубочек соединены между собой эластичным белком нексином. С субфибриллой А связаны наружные и внутренние ручки. В их состав входит белок динеин, сожержащий 2-3 глобулярные головки, соединенные с гибкой фибриллярной частью молекулы. Основание фибриллярной части вплетено в микротрубочку (субфибрилла А). Глобулярная головка обладает АТФазной активностью. При расщеплении АТФ она скользит по поверхности микротрубочки (субфибрилла В) соседней пары по напарвлению к ее (-)-концу. Этот механизм аналогичен скольжению элементов актомиозинового хемомеханического преобразователя в мышце. Аксонема – основной структурный элемент реснички и жгутика.
Базальное тельце состоит из 9 триплетов микротрубочек, расположенных в основании реснички или жгутика; служит матрицей при организации аксонемы.
Ресчника - вырост клетки длиной 5-10 мкм и шириной 0,2 мкм, содержащей аксонему. Реснички присутствуют в эпителиальных клетках воздухопроводящих и половых путей, перемещают слизь с инородными частицами и остатками отмерших клеток и создают ток жидкости около клеточной поверхности.
Жгутик, как правило, не встречается в количестве более двух на клетку. В сперматозоиде человека жгутик имеет длину 50-55 мкм, толщину 0,2-0,5 мкм и содержит аксонему.
Киноцилия – (греч. kinesis, движение; cilium, ресничка) специальная рпганелла подвижности на поверхности волосковых клеток органа равновесия.