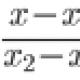Регуляция активности ферментов. Медицинская энзимология (биохимия)
Ферменты являются регулируемыми катализаторами. В качестве регуляторов могут выступать метаболиты, яды. Различают:
- активаторы – вещества, увеличивающие скорость реакции;
- ингибиторы – вещества, уменьшающие скорость реакции.
Активация ферментов . Различные активаторы могут связываться либо с активным центром фермента, либо вне его. К группе активаторов, влияющих на активный центр, относятся: ионы металла, коферменты, сами субстраты.
Активация с помощью металлов протекает по различным механизмам:
Металл входит в состав каталитического участка активного центра;
Металл с субстратом образуют комплекс;
За счет металла образуется мости между субстратом и активным центром фермента.
Субстраты также являются активаторами. При увеличении концентрации субстрата скорость реакции повышается. по достижению концентрации насыщения субстрата эта скорость не изменяется.
Если активатор связывается вне активного центра фермента, то происходит ковалентная модификация фермента :
1) частичный протеолиз (ограниченный протеолиз). Таким образом активируются ферменты пищеварительного канала: пепсин, трипсин, химотрипсин. Трипсин имеет состояние профермента трипсиногена, состоящего из 229 АК остатков. Под действием фермента энтерокиназы и с добавлением воды он превращается в трипсин, при этом отщепляется гексапептид. Изменяется третичная структура белка, формируется активный центр фермента и он переходит в активную форму.
2) фосфорилирование - дефосфорилирование. Пр.: липаза+АТФ= (протеинкиназа) фосфорилированная липаза+АДФ. Это трансферная реакция, использующая фосфат АТФ. При этом осуществляется перенос группы атомов от одной молекулы к другой. Фосфорилированная липаза является активной формой фермента.
Таким же путем происходит активация фосфорилазы: фосфорилаза B+ 4АТФ= фосфорилаза А+ 4АДФ
Также при связывании активатора вне активного центра происходит диссоциация неактивного комплекса «белок-активный фермент». Например, протеинкиназа – фермент, осуществляющий фосфорилирование (цАМФ-зависимое). Протеинкиназа – это белок, имеющий четвертичную структуру и состоящий из 2-х регуляторный и 2-х каталитических субъединиц. R 2 C 2 +2цАМФ=R 2 цАМФ 2 + 2С. Такой тип регуляции называется аллостерической регуляцией (активацией).
Ингибирование ферментов . Ингибитор – это вещество, вызывающее специфическое снижение активности фермента. Следует различать ингибирование и инактивацию. Инактивация – это, например, денатурация белка в результате действия денатурирующих агентов.
По прочности связывания ингибитора с ферментом ингибиторы делят на обратимые и необратимые.
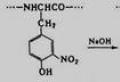
Необратимые ингибиторы прочно связаны и разрушают функциональные группы молекулы фермента, которые необходимы для проявления его каталитической активности. Все процедуры по очистке белка не влияют на связь ингибитора и фермента. Пр.: действие фосфорорганических соединений на фермент – холинэстеразу. Хлорофос, зарин, зоман и др. фосфорорганические соединения связываются с активным центром холинэстеразы. В результате происходит фосфорилирование каталитических групп активного центра фермента. В следствии молекулы фермента, связанные с ингибитором, не могут связываться с субстратом и наступает тяжелое отравление.
Также выделяют обратимые игнибиторы , например прозерин для холинэстеразы. Обратимое ингибирование зависит от концентрации субстрата и ингибитора и снимается избытком субстрата.
По механизму действия выделяют:
Конкурентное ингибирование;
Неконкурентное ингибирование;
Субстратное ингибирование;
Аллостерическое.
1) Конкурентное (изостерическое) ингибирование – это торможение ферментативной реакции, вызванное связыванием ингибитора с активным центром фермента. При этом ингибитор имеет сходство с субстратом. В процессе происходит конкуренция за активный центр: образуются фермент-субстратные и ингибитор-ферментные комплексы. E+S®ES® EP® E+P; E+I® E. Пр.: сукцинатдегидрогеназная реакция [рис. COOH-CH 2 -CH 2 -COOH®(над стрелкой СДГ, под ФАД®ФАДН 2) COOH-CH=CH-COOH]. Истинным субстратом этой реакции является сукцинат (янтарная к-та). Ингибиторы: малоновая к-та (COOH-CH 2 -COOH) и оксалоацетат (COOH-CO-CH 2 -COOH). [рис. фермента с 3 дырками+ субстрат+ ингибитор= комплекс ингибитора с ферментом]
Пр.: фермент холинэстераза катализирует превращение ацетилхолина в холин: (CH 3) 3 -N-CH 2 -CH 2 -O-CO-CH 3 ® (над стрелкой ХЭ, под – вода) CH 3 СOOH+(CH 3) 3 -N-CH 2 -CH 2 -OH. Конкурентными ингибиторами являются прозерин, севин.
2) Неконкурентное ингибирование – торможение, связанное с влиянием ингибитора на каталитическое превращение, но не на связывание фермента с субстратом. В этом случае ингибитор может связываться и с активным центром (каталитический участок) и вне его.
Присоединение ингибитора вне активного центра приводит к изменению конформации (третичной структуры) белка, вследствие чего изменяется конформация активного центра. Это затрагивает каталитический участок и мешает взаимодействию субстрата с активным центром. При этом ингибитор не имеет сходства с субстратом и это ингибирование нельзя снять избытком субстрата. Возможно образование тройных комплексов фермент-ингибитор-субстрат. Скорость такой реакции не будет максимальной.
К неконкурентным ингибиторам относят:
Цианиды. Они связываются с атомом железа в цитохромоксидазе и в результате этого фермент теряет свою активность, а т.к. это фермент дыхательной цепи, то нарушается дыхание клеток и они гибнут.
Ионы тяжёлых металлов и их органические соединения (Hg, Pb и др.). Механизм их действия связан с соединением их с различными SH-группами. [рис. фермента с SH-группами, иона ртути, субстрата. Все это соединяется в тройной комплекс]
Ряд фармакологических средств, которые должны поражать ферменты злокачественных клеток. Сюда же относятся ингибиторы, использующиеся в сельском хозяйстве, бытовые отравляющие вещества.
3) Субстратное ингибирование – торможение ферментативной реакции, вызванное избытком субстрата. Происходит в результате образования фермент-субстратного комплекса, неспособного подвергаться каталитическому превращению. Его можно снять и уменьшить концентрацию субстрата. [рис. связывания фермента сразу с 2 субстратами]
4) Аллостерическое ингибирование – торможение ферментативной реакции, вызванное присоединением аллостерического ингибитора в аллостерическом центре аллостерического фермента. Такой тип ингибирования характерен для аллостерических ферментов, имеющих четвертичную структуру. В качестве ингибиторов могут выступать метаболиты, гормоны, ионы металлов, коферменты.
Механизм действия:
а) присоединение ингибитора к аллостерическому центру;
б) изменяется конформация фермента;
в) изменяется конформация активного центра;
г) нарушается комплиментарность активного центра фермента к субстрату;
д) уменьшается число молекул ES;
е) уменьшается скорость ферментативной реакции.
[рис. фермент с 2 дырками, к одной аллостерический ингибитор и вторая меняет форму]
К особенностям аллостерических ферментов относят ингибирование по отрицателтной обратной связи. A®(E 1)B®(E 2) C®(E 3) D (от D стрелочка к стрелке между А и В). D – метаболит, действующий как аллостерический ингибитор на фермент Е 1 .
Обмен веществ
Обмен веществ (метаболизм) – это совокупность физиологических и биохимических процессов, обеспечивающих жизнедеятельность организма во взаимосвязях с внешней средой, направленных на самовоспроизведение и самосохранение.
К физиологическим процессам относятся пищеварение, всасывание, внешнее дыхание, выделение и др.; к биохимическим – химические превращения белков, жиров, углеводов, поступающих в организм в виде пищевых веществ. Особенностью биохимических процессов является то, что они осуществляются в ходе ряда ферментативных реакций. Именно ферменты обеспечивают определенную последовательность, места и скорость реакций.
По направленности все химические превращения делят на:
а) диссимиляция (катаболизм) – распад веществ до более простых с переходом энергии связей вещества в энергию макроэргических связей (АТФ, НАД·Н, др.);
б) ассимиляция (анаболизм) – синтез более сложных веществ из более простых с затратой энергии.
Биологическое значение этих двух процессов состоит в том, что при расщеплении веществ освобождается заключенная в них энергия, которая обеспечивает все функциональные возможности организма. В то же время, при распаде веществ образуются "строительные материалы" (моносахариды, АК, глицерин и др.), которые затем используются в синтезе специфических организму веществ (белков, жиров, углеводов и др.).
[СХЕМА] Над горизонтальной линией (во внешней среде) – "белки, жиры, углеводы", от них стрелка вниз под линию (внутри организма) к надписи "диссимиляция", от последней четыре стрелки: две вверх к надписям над линией "теплота" и "конечные продукты"; одна стрелка вправо к надписи "промежуточные вещества (метаболиты)", от них к "ассимиляция", затем к "собственные белки, жиры, углеводы"; одна стрелка вниз к надписи "энергия АТФ", от нее – к "мышечное сокращение, проведение нервного импульса, секреция и др." а также наверх к "теплота" и "ассимиляция".
Диссимиляция белков, жиров и углеводов протекает по-разному, но в разрушении этих веществ есть ряд общих этапов:
1) Этап переваривания . В ЖКТ белки распадаются до АК, жиры – до глицерина и ВЖК, углеводы – до моносахаридов. Нарабатывается большое количество неспецифических веществ из специфических, поступающих извне. За счет переваривания в ЖКТ выделяется около 1% химической энергии веществ. Этот этап необходим для того, чтобы вещества, поступившие с пищей, смогли всосаться.
2) Этап межуточного обмена (тканевой обмен веществ, метаболизм ). На клеточном уровне он распределяется на анаболизм и катаболизм. Образуются и превращаются промежуточные вещества обмена веществ – метаболиты . При этом мономеры, образовавшиеся на этапе переваривания, распадаются с образованием небольшого (до пяти) ключевых промежуточных продуктов: ЩУК, альфа-КГ, ацетил-КоА, ПВК, альфа-глицерофосфат. Выделяется до 20% энергии веществ. Как правило, межуточный обмен происходит в цитоплазме клеток.
3) Окончательный распад веществ с участием кислорода до конечных продуктов (СО 2 , Н 2 О, азотсодержащие вещества). Выделяется около 80% энергии веществ.
Все рассмотренные этапы отражают лишь главные формы обменных процессов. Как на втором, так и на третьем этапах выделяющаяся энергия накапливается в виде энергии химических связей макроэргических соединений (это вещества, имеющие хотя бы одну макроэргическую связь, напр., АТФ, ЦТФ, ТТФ, ГТФ, УТФ, АДФ, ЦДФ, …, креатинфосфат, 1,3-дифосфоглицериновая кислота). Так, энергия связи последнего фосфата в молекуле АТФ составляет около 10-12 ккал/моль.
Биологическая роль обмена веществ:
1. аккумуляция энергии при распаде химических соединений;
2. использование энергии для синтеза собственных веществ организма;
3. распад обновляемых структурных компонентов клетки;
4. происходит синтез и распад биомолекул специального назначения.
Обмен белков
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Белки и их биологическая роль
Белок (протеины) – protos – предшествующий всему, первичный, наиглавнейший, определяющий всё остальное.
Белки – это высокомолекулярные азотсодержащие органические вещества, состо
Характеристика простых белков
В основе классификации (создана в 1908г.) лежит растворимость белков. По этому признаку выделяют:
I. гистоныипротамины, растворимые в солевых растворах. О
Хромопротеины
Для них простетическая часть окрашена (chromos – краска). К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидокс
Липид-белковые комплексы
Липид-белковые комплексы – сложные белки, простетическую часть которых составляют различные липидные компоненты. К таким компонентам относятся:
1. предельные и непредельные В
Нуклеопротеины
Нуклеопротеины – это сложные белки, содержащие в качестве небольшой части нуклеиновые кислоты (до 65%).
НП состоят из 2-х частей: белковой (содержит гистоны и протамины, кото
Углевод-белковые комплексы
В качестве простетической группы выступают углеводы. Все углевод-белковые комплексы делятся на гликопротеины и протеогликаны.
Гликопротеины (ГП)– комплекс белков с углеводными ко
Фосфопротеины
Белки, где в качестве простетической группы – фосфорная кислота. Присоединение фосфорной кислоты к полипептидной цепи идет с образованием сложноэфирной связи с АК СЕР или ТРЕ.
Строение коферментов
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
- ковалентными связями;
- ионными
Изоферменты
Изоферменты – это изофункциональные белки. Они катализируют одну и ту же реакцию, но отличаются по некоторым функциональным свойствам в силу отличий по:
- аминокислотному составу;
Свойства ферментов
Общие черты ферментов и небиологических катализаторов:
1) и те, и другие катализируют только энергетически возможные реакции;
2) увеличивают скорость реакции;
3) н
Номенклатура ферментов
1) Существует тривиальная номенклатура – названия случайные, без системы и основания, например трипсин, пепсин, химотрипсин.
2) Рабочая номенклатура – название фермента составляется из наз
Современные представления о ферментативном катализе
Первая теория ферментативного катализа была выдвинута в начале 20 века Варбургом и Бейлисом. Эта теория предлагала считать, что фермент адсорбирует на себе субстрат, и называлась адсорбционной, но
Молекулярные эффекты действия ферментов
1) Эффект концентрирования – это адсорбирование на поверхности молекулы фермента молекул реагирующих веществ, т.е. субстрата, что приводит к их лучшему взаимодействию. Пр.: электростатическое притя
Теория кислотно-основного катализа
В составе активного центра фермента имеются как кислые, так и основные функциональные группы. В результате этого фермент проявляет в ходе катализа кислотно-основные свойства, т.е. играет как роль д
Переваривание и всасывание белков
Функции белков многообразны, но особенно выделяются структурная, каталитическая и энергетическая функции. Энергетическая ценность белка около 4,1 ккал/г.
Среди всех веществ, поступающих в
Превращение белков в органах пищеварения
Все белки подвергаются действию гидролаз (третий класс ферментов), а именно пептидаз – они, как правило, вырабатываются в неактивной форме, а затем активируются путем частичного протеолиза.
Переваривание сложных белков и их катаболизм
1. Гликопротеины гидролизуются с помощью гликозидаз (амилолитических ферментов).
2. Липопротеины – с помощью липолитических ферментов.
3. Гемсодержащие хромопроте
Гниение белков и обезвреживание его продуктов
Гниение белков – это бактериальный распад белковых веществ и АК под действием микрофлоры кишечника. Идет в толстой кишке, однако может наблюдаться и в желудке – при снижении кислотнос
Метаболизм аминокислот
Фонд АК организма пополняется за счет процессов:
1) гидролиза белков пищи,
2) гидролиза тканевых белков (под действием катепсинов лизосом).
Расходуется АК-фонд на процесс
Общие пути обмена веществ
1. Переаминирование (открыто в 1937 г. Браунштейном и Крицмом).
Временное обезвреживание аммиака
Аммиак токсичен (50 мг аммиака убивает кролика, при этом =0,4-0,7 мг/л). Поэтому в тканях аммиак обезвреживается временными путями:
1) в основном – образов
Орнитиновый цикл мочевинообразования
Мочевина содержит 80-90% всего азота мочи. В сутки образуется 25-30 г мочевины NH2-CO-NH2.
1. NH3 + CO
Синтез и распад нуклеотидов
Особенности обмена нуклеотидов:
1. Ни сами нуклеотиды, ни азотистые основания, поступающие с пищей, не включаются в синтез нуклеиновых кислот и нуклеотидов организма. Т.е., нуклеотиды пищи
Окисление пуриновых нуклеозидов
Аденозин® (аденозиндезаминаза, +Н2О, –NH4+) инозин® (пуриннуклеозидфосфорилаза, +Фн –рибозил-1-Ф) гипоксантин (6-оксопурин) ® (ксантинокси
Функционирование ДЦ
Субстрат·Н2 → НАД → ФМН → КоQ → 2b → 2c1→ 2c → 2a → 2a3 → O
Репликация (самоудвоение, биосинтез) ДНК
В 1953 г. Уотсон и Крик открыли принцип комплементарности (взаимодополняемости). Так, А=Т, а ГºЦ.
Условия, необходимые для репликации:
1. стр
Транскрипция (передача информации с ДНК на РНК) или биосинтез РНК
При транскрипции, в отличие от репликации, информации передается с небольшого участка ДНК. Элементарной единицей транскрипции является оперон (транскриптон)- участок ДНК, подвергающийся тран
Регуляция биосинтеза белка
Клетки многоклеточного организма содержат одинаковый набор ДНК, но белки синтезируются разные. Например, соединительная ткань активно синтезирует коллаген, а в мышечных клетках такого белка нет. В
Механизмы развития раковой опухоли
Рак – генетическое заболевание, т.е. повреждение генов.
Виды повреждений генов:
1) потеря гена,
2) собственно повреждение гена,
3) активация гена,
Переваривание липидов
Поступая с пищей, липиды в ротовой полости подвергаются только механической обработке. Липолитические ферменты в ротовой полости не образуются. Переваривание липидов будет происходить в тех отделах
Механизм ресинтеза жира
Ресинтез жира в стенке кишечника происходит следующим образом:
1. сначала продукты гидролиза (глицерин, ВЖК) активируются с использованием АТФ. Далее происходит последовательное ацилирован
Транспортные формы липидов в организме
Липиды являются нерастворимыми в воде соединениями, поэтому для их переноса кровью необходимы специальные переносчики, растворимые в воде. Такими транспортными формами являются липопротеины плазмы
Превращение липидов в тканях
В тканях постоянно идут процессы распада и синтеза липидов. Основную массу липидов организма человека составляют ТГ, которые в клетке имеются в виде включений. Период обновления ТГ в разных тканях
Биосинтез глицерина и ВЖК в тканях
Биосинтез глицерина в тканях тесно связан с метаболизмом глюкозы, которая в результате катаболизма проходит стадии образования триоз. Глицеральдегид–3–фосфат в цитоплазме по
Патология липидного обмена
На этапе поступления с пищей. Обильная жирная пища на фоне гиподинамии ведёт к развитию алиментарного ожирения. Нарушение обмена может быть связано с недостаточным поступлением жир
Ионы Са2+
Образуют соединение с белком - кальмодулин. Комплекс Са2+-кальмодулин активирует ферменты (аденилатциклазу, фосфодиэстеразу, Са2+-зависимую протеинкиназу). Есть группа
Гормоны паращитовидных желез
Парат-гормон, состоит из 84 АК, регулирует уровень Са2+, стимулирует выход кальция (и фосфора) из костей в кровь; Повышают реабсорбцию кальция в почках, но стимулируется выход фосфора; С
Роль витаминов в обмене веществ
1.(!) витамины – предшественники коферментов и простетических групп ферментов.
Напр., В1 – тиамин – входит в состав кофермента декарбоксилаз кетокислот в виде ТПФ (ТДФ), В2 – рибофлавин –
Понятие о гиповитаминозах, авитаминозах и гипервитаминозах
Гиповитаминоз – патологическое состояние, связанное с недостатком витамина в организме.
Авитаминоз – патологическое состояние, вызванное отсутствием витамина в организме.
Причины гиповитаминозов
1. Первичные: недостаток витамина в пище.
2. Вторичные:
а) снижение аппетита;
б) повышенный расход витаминов;
в) нарушения всасывания и утилизации, напр., энтеро
Витамин А
Витамеры: А1 – ретинол и А2 – ретиналь.
Клиническое название: антиксерофтальмический витамин.
По химической природе: циклический непредельный одноатомный спирт на основе кольца b-
Витамин D
Антирахитический витамин. Существуют два витамера:
D2 – эргокальциферол и D3 – холекальциферол.
Витамин D2 содержится в грибах. Витамин D3 синтезируется в орг
Витамин Е
Устар.: антистерильный витамин, антиоксидантный энзим.
В химическом плане это альфа-, бета-, гамма- и дельта-токоферолы, но преобладающим является альфа-токоферол.
Витамин Е устой
Витамин К
Антигеморрагический витамин.
Витамеры: К1 – филлохинон и К2 – менахинон.
Роль витамина К в обмене веществ
Это кофактор карбоксилирования глутамино
Пантотеновая кислота. [рис. формулы НОСН2-С((СН3)2)-СН(ОН)-СО-NH-СН2-СН2-СООН] Состоит из масляной кислоты с b-аланином.
Гидроксилирование ксенобиотиков с участием микросомальной монооксигеназной системы
1. бензола:
[рис. бензол+ О2 +НАДФН2®(гидроксилаза, цитохром Р450) фенол + НАДФ+ Н2О]
2. индола:
[рис. индол+ О2 +Н
Роль печени в пигментном обмене
Пигментный обмен представляет собой совокупность сложных взаимопревращений окрашенных веществ тканей и жидкостей организма человека.
К пигментам относятся 4 группы веществ:
1. гем
Биосинтез гема
Биосинтез гема идет в большинстве тканей, за исключением эритроцитов, которые не имеют митохондрий. В организме человека гем синтезируется из глицина и сукцинил-КоА, образованного в результате мета
Распад гема
Большая часть гемхромагенных пигментов в организме человека образуется при распаде гема. Главным источником гема является гемоглобин. В эритроцитах содержание гемоглобина составляет 80%, время жизн
Патология пигментного обмена
Как правило, связана с нарушением процессов катаболизма гема и выражается гипербилирубинемией и проявляется в желтушечности кожи и видимых слизистых оболочек. Накапливаясь в ЦНС, билирубин вызывает
Типы изменения биохимического состава крови
I. Абсолютные и относительные.
Абсолютные обусловлены нарушением синтеза, распада, выведения того или иного соединения.
Относительные обусловлены изменением объема ц
Белковый состав крови
Функции белков крови:
1. поддерживают онкотическое давление (в основном за счет альбуминов);
2. определяют вязкость плазмы крови (в основном за счет альбуминов);
Общий белок
В норме общий белок крови 65-85 г/л.
Общий белок – это сумма всех белковых веществ крови.
Гипопротеинемия – снижение альбуминов. Причины:
Глобулины в норме 20-30 г/л
I. α1 -глобулины
α-антитрипсин – ингибирует трипсин, пепсин, эластазу, некоторые другие протеазы крови. Выполняет антивоспалитель
Остаточный азот
Остаточный азот – это сумма азота всех небелковых азотсодержащих веществ крови. В норме 14-28 ммоль/л.
1. Метаболиты:
1.1. аминокислоты (25%);
1.2. креат
Углеводный обмен
Глюкоза в капиллярной крови натощак 3,3-5,5 ммоль/л.
1. Гипергликемия (повышение глюкозы):
1.1. панкреатическая гипергликемия – при отсутствии инсул
Липидный обмен
Холестерин в норме 3-5,2 ммоль/л. В плазме находится в составе ЛПНП, ЛПОНП (атерогенные фракции) и ЛПВП (антиатерогенная фракция). Вероятность развития атеросклероза
Минеральный обмен
Натрий – это основной внеклеточный ион. На уровень Na+ в крови влияют минералокортикоиды (альдостерон задерживает натрий в почках). Уровень натрия увеличивается за счет гем
Ферменты плазмы крови
Классифицируются:
1. Функционирующие ферменты (собственно плазменные). Напр., ренин (повышает АД через ангиотензин II), холинестераза (расщепляет ацетилхолин). Их активность выше в
Физические свойства мочи здорового человека, их изменения при патологии
I. Количество мочи в норме 1,2-1,5 л.
Полиурия – увеличение количества мочи из-за:
1) увеличения фильтрации (под действием адреналина увеличивается фи
Показатели химического состава мочи
Общий азот – это совокупность азота всех азотсодержащих веществ в моче. В норме – 10-16 г/сутки. При патологиях общий азот может:
ü увеличиваться – гиперазотурия
Особенности обмена веществ в нервной ткани
Энергетический обмен.
В ткани головного мозга увеличено клеточное дыхание (преобладают аэробные процессы). Мозг потребляет большее количество кислорода, чем постоянно работающее сер
Химическая передача нервного возбуждения
Передача возбуждения с одной клетки на другую происходит с помощью нейромедиаторов:
- нейропептидов;
- АК;
- ацетилхолина;
- биогенных аминов (адреналин,
И активаторы, повышающие ферментативную активность. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. Обратимые ингибиторы связываются с ферментами слабыми нековалентными связями и при определенных условиях легко отделяются от фермента, действуют кратковременно. Обратимые ингибиторы делятся на конкурентные и неконкурентные.
Конкурентные ингибиторы имеют структурное сходство с субстратом, в результате чего возникает конкуренция молекул субстрата и ингибитора за связывание с активным центром фермента. В этом случае с активным центром взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ЕS) или фермент-ингибитор (ЕI). При формировании ЕI комплекса продукт реакции не образуется. Активность фермента может быть восстановлена при повышении концентрации субстрата. Многие лекарственные препа-раты действуют как конкурентные ингибиторы. Например, сульфаниламиды , обладающие бактериостатическим действием, являются аналогами пара-аминобензойной кислоты , которую бактерии используют для синтеза фолиевой кислоты (необходимой для синтеза нуклеотидов и деления клеток).
Неконкурентные ингибиторы не похожи на субстрат, поэтому взаимодействуют с ферментом в участке, отличном от активного центра.
Необратимые ингибиторы образуют прочные ковалентные связи с ферментом, при этом чаще модификации подвергается активный центр фермента. В результате фермент не может выполнять свою каталитическую функцию. Например, фосфорорганические соединения ковалентно связывают ОН-группу серина , находящуюся в активном центре и играющую ключевую роль в процессе катализа . Такие ингибиторы, если используются как лекарства, действуют длительно (сутки, недели). Восстановление ферментативной активности может быть связано с синтезом новых молекул фермента.
Большинство ферментативных процессов в клетке протекают не в одну стадию, а представляют собой совокупность ферментативных реакций, объединенных в ферментативные цепи (метаболические пути), которые могут быть линейными (гликолиз), разветвленными, циклическими (цикл Кребса). Чтобы воздействовать на скорость метаболического пути, достаточно регулировать количество или активность ферментов. В метаболических путях нет надобности регулировать активность всех ферментов, обычно регулируется активность ключевых ферментов, которые определяют скорость метаболического процесса в целом.
Ключевыми ферментами являются:
· ферменты начала метаболического пути (первый фермент),
· ферменты, катализирующие скорость-лимитирующие (самые медленные) реакции,
· ферменты, находящиеся в месте разветвления метаболических путей.
Регуляция скорости ферментативных реакций может осуществляться путем:
· изменения количества молекул фермента,
· доступностью молекул субстрата и кофермента ,
· регуляции каталитической активности молекул отдельных ферментов.
Регуляция количества молекул фермента в клетке может осуществляться путем изменения скорости его синтеза (индукция - увеличение скорости синтеза, репрессия - торможение) или путем изменения скорости его распада.
Важный параметр, контролирующий протекание метаболического пути, - наличие субстратов, главным образом - первого, чем больше его концентрация, тем выше скорость метаболического пути.
Регуляция каталитической активности отдельных ферментов . Основными способами регуляции являются: аллостерический и изостерический механизмы, регуляция с помощью белок-белковых взаимодействий, путем химической модификации, ограниченного (частичного) протеолиза.
Изостерическиймеханизм . В этом случае регулятор воздействует непосредственно на активный центр фермента. По такому механизму действуют конкурентные ингибиторы, некоторые металлы.
Аллостеричесий механизм. Многие ферменты помимо активного центра имеют еще и аллостерический центр, пространственно удаленный от активного центра. Аллостерические ферменты обычно являются олигомерными белками, состоящими из нескольких субъединиц. К аллостерическому центру нековалентно присоединяются эффекторы. В их роли могут выступать субстраты, конечные продукты метаболического пути, коферменты, макроэрги (причем АТФ и АДФ действуют как антагонисты: АТФ активирует процессы анаболизма и ингибирует катаболизм, АДФ - наоборот).
Аллостерических центров у фермента может быть несколько. Аллостерические ферменты обладают свойством положительной и отрицательной кооперативности. Взаимодействие эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению формы активного центра, что снижает или увеличивает сродство к субстрату, а значит, соответственно, уменьшает или увеличивает каталитическую активность фермента.
Внутримолекулярное взаимодействие белок - белок (только для олигомерных ферментов) с изменением олигомерности. ПротеинкиназаА - фермент, который фосфорилирует белки за счет АТФ, состоит из 4 субъединиц двух типов: двух субъединиц регуляторных и двух каталитических. Такой тетрамер не обладает каталитической активностью. При диссоциации тетрамерного комплекса освобождаются две каталитические субъединицы и фермент становится активным. Такой механизм регуляции обратим. Ассоциация регуляторных и каталитических субъединиц протенкиназы А вновь приводит к образованию неактивного комплекса.
химической модификации. Это наиболее часто встречаемый механизм регуляции активности ферментов путем ковалентной модифи-кации аминокислотных остатков. При этом модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами за счет АТФ. Присоединение остатка фосфорной кислоты приводит к изменению каталитической активности, при этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие - становятся менее активными. Изменение активности путем фосфорилирования обратимо. Отщепление остатка фосфорной кислоты осуществляется протенфосфатазами.
Регуляция активности ферментов путем ограниченного протеолиза . Некоторые ферменты синтезируются в виде неактивных предшественников - проферментов и активируются в результате гидролиза одной или нескольких определенных пептидных связей, что приводит к отщеплению части белковой молекулы профермента. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр и фермент становится активным. Отщепление пептида от белков-предшественников катализируют ферменты пептидазы.
При этом активность фермента изменяется необратимо. Ограниченный протеолиз лежит в основе активации протеолитических ферментов ЖКТ, белков свертывающей системы крови и системы фибринолиза, а также белково-пептидных гормонов. Например, трипсиноген, синтезируемый в поджелудочной железе, поступает в кишечник, где на него действует фермент энтеропептидаза. В результате происходит ограниченный протеолиз с отщеплением гексапептида. При этом в оставшейся части молекулы формируется активный центр и образуется активный трипсин.
Изменение активности фермента – наиболее быстрый путь воздействия на скорость протекания реакции. На активность фермента воздействуют физические факторы (температура, свет, давление и т.д.), действие этих факторов в большинстве случаев неспецифично. Специфически действуют на активность ферментов химические факторы. Здесь можно выделить несколько случаев. Во-первых, фактор может связываться с активным центром фермента, что чаще всего ведет к утрате каталитической активности. Так может действовать сам субстрат в случае отсутствия каких-либо необходимых для протекания реакции факторов, либо активный центр фермента может блокироваться другим агентом в случае конкурентного ингибирования. Во-вторых, может происходить химическая модификация фермента под действием другого фермента.
Наиболее тонким и широко распространенным способом регуляции активности ферментов является аллостерическая регуляция . В этом случае регуляторный фактор связывается не с каталитическим центром фермента, а с другим его участком (регуляторным центром ), что приводит к изменению активности фермента. Ферменты, регулируемые таким образом, называются аллостерическими , они часто занимают ключевую позицию в метаболизме. Вещество, связывающееся с регуляторным центром называется эффектором , эффектор может быть ингибитором , а может быть активатором .Обычно эффекторами бывают либо конечные продукты биосинтетических путей (ингибирование по принципу обратной связи), либо вещества, концентрация которых отражает состояние клеточного метаболизма (АТФ, АМФ, НАД+ и др.). Как правило, аллостерические ферменты катализируют одну из реакций, с которой начинается процесс образования какого-то метаболита. Обычно эта стадия лимитирует скорость всего процесса в целом. В катаболических процессах, сопровождающихся синтезом АТФ из АДФ, в роли аллостерического ингибитора одной из ранних стадий катаболизма часто выступает сам конечный продукт – АТФ. Аллостерическим ингибитором одной из ранних стадий анаболизма нередко служит конечный продукт биосинтеза, например какая-нибудь аминокислота. Так, например, аллостерическим ферментом является, треониндезаминаза , фермент, катализирующий первую стадию биосинтеза изолейцина из треонина; изолейцин является ингибитором этого фермента (рис. 31). Это типичный пример ингибирования по принципу обратной связи.
Рис. 31. Схема регуляции биосинтеза L-изолейцина по механизму отрицательной обратной связи:
Ф1 – аллостерический фермент треониндезаминаза, Ф2 – Ф5 – ферменты, катализирующие промежуточные стадии биосинеза изолейцина. Стрелка показывает ингибирование треониндезаминазы L-лейцином, конечным продуктом данного биосинтетического пути
Активность некоторых аллостерических ферментов стимулируется специфическими активаторами. Аллостерический фермент, регулирующий одну из катаболических последовательностей реакций, может, например, подчиняться стимулирующему влиянию положительных эффекторов – АДР или АМР и ингибирующему действию отрицательного эффектора – АТР. Известны также случаи, когда аллостерический фермент какого-нибудь метаболического пути специфическим образом реагирует на промежуточные или конечные продукты других метаболических путей. Благодаря этому оказывается возможной координация скорости действия различных ферментных систем.
Основным положением ферментативной кинетики является представление о фермент-субстратных комплексах (ES). Как в случае неорганических катализаторов, фермент обеспечивает протекание реакции по более эффективному пути, с более низкой энергией активации. Более высокая каталитическая активность ферментативной реакции обусловлена тем, что процесс идет через стадию образования ES. Скорость ферментативных реакций в 10 3 - 10 13 раз выше скорости не каталитической реакции. Такое резкое увеличение скорости обусловлено двумя причинами - эффектом сближения, который наблюдается и в неферментных реакциях и эффектом ориентации, который исключительно результативно осуществляется именно в ферментативных реакциях.
Молекулы ферментов в отличие от других катализаторов имеют очень сложное строение. Это дает возможность реализовать такие механизмы повышения скорости реакций, которые невозможны с небиологическими катализаторами. Здесь возможны взаимодействия особого рода, отсутствующие в обычном катализе. Если допустить, что связывание субстрата на молекуле фермента происходит не в одной, а трех точках, то одно это уже резко увеличивает вероятность необходимых ориентаций и на несколько порядков повышает скорость реакции.
В образовании фермент-субстратных комплексов могут принимать участие ковалентные, ионные, водородные связи, гидрофобные взаимодействия. Каталитическая активность фермента связана с его пространственной структурой, в которой жесткие участки спиралей чередуются с гибкими эластичными линейными отрезками.
При объяснении механизма действия ферментов широкое признание получила гипотеза «индуцированного» или «вынужденного» соответствия Кошленда. В соответствии с этой гипотезой необходимое расположение функциональных групп активного центра фермента происходит под воздействием субстрата. Реакционно-способная конформация всей молекулы фермента и его активного центра возникает в результате деформирующего воздействия субстрата. При этом следует иметь в виду, что индуцированное соответствие создается не только изменением конформации фермента, но и перестройкой молекулы субстрата.
Гипотеза «вынужденного соответствия» была экспериментально подтверждена, когда было доказано изменение расположения функциональных групп активного центра в процессе присоединения субстрата. Специфичность фермента обусловлена, вероятно, возможностью конформационных перестроек активного центра. Если возможности перестройки велики, то фермент может взаимодействовать с несколькими близкими по структуре субстратами и проявляет групповую специфичность, если возможность резко ограничена, то фермент высоко специфичен.
Гипотеза индуцированного соответствия предполагает наличие между ферментом и субстратом не только пространственной комплементарности, но и электростатического взаимодействия, обусловленного противоположно заряженными группами субстрата и фермента.
В организме реализуется одновременно огромное количество биохимических реакций важных для процессов жизнедеятельности, которые должны строго регулироваться в соответствии с потребностями организма. Эта регуляция должна обеспечивать поставку необходимых компонентов в заданный отрезок времени с наименьшими затратами энергии. Так как практически любая биологически важная реакция - это ферментативная реакция, то ясно, что такая регуляция осуществляется главным образом путем контроля ферментов, катализирующих ключевые метаболические реакции.
Скорость образования конечного продукта метаболического пути может регулироваться или путем изменения активности соответствующих ферментов или путем увеличения или уменьшения числа молекул фермента (индукция или репрессия).
Регулирование активностей ферментов в клетке происходит различными путями. Для большинства ферментов, которые подчиняются уравнению Михаэлиса-Ментен, важным регуляторным фактором является концентрация субстрата. Была введена величина К м представляющая концентрацию субстрата, при которой скорость реакции составляет 50% максимальной. Так как в клетке концентрация субстратов близка к К м или несколько ниже ее, то незначительные изменения концентрации субстратов приводят к относительно большим изменениям скоростей реакций.
Регуляция активности фермента может осуществляться за счет прямого воздействия на центры связывания субстрата, например, ингибирование фермента аналогами субстрата.
Прочно связываются с активным центром фермента ингибиторы белковой природы. Например, ингибитор трипсина - белок с молекулярной массой 6000. Он обладает сильным ингибирующим эффектом, так как строго комплементарен структуре активного центра фермента.
Однако гораздо чаще встречается аллостерический (нековалентный) тип регуляции активности ферментов.
Аллостерическая регуляция характерна для ферментов, состоящих из 2 и более субъединиц и имеющих более одного субстратсвязывающего центра. Эти ферменты содержат аллостерические центры (отличные от субстратсвязывающих), которые способны связывать определенные вещества, носящие название аллостерических эффекторов. Если связывание эффектора снижает скорость ферментативной реакции, то его называют аллостерическим ингибитором, если увеличивает - аллостерическим активатором. В качестве аллостерических эффекторов ферментов выступают различные метаболиты, гормоны, коферменты. Одним из путей регуляции аллостерических ферментов является угнетение посредством «отрицательной обратной связи» или «ретроингибирование», т.е. угнетение конечным продуктом реакции. Некоторые молекулы ферментов имеют несколько аллостерических центров, одни из которых специфичны к положительным, другие к отрицательным эффекторам. Аллостеричекие центры ферментов так же, как и активные центры, могут проявлять резко выраженную специфичность, когда они могут связывать только один определенный эффектор или относительную, когда может происходить связывание сходных по структуре эффекторов.
Механизм действия аллостерического эффектора связан с изменением конформации субъединиц из которых построен фермент, что сказывается на каталитической активности фермента.
Аллостерическая регуляция является одним из самых тонких и высоко специфичных механизмов «быстрого реагирования» на те или иные процессы в окружающей среде и используется для точной настройки метаболических систем. Эффектор может действовать только в одной или нескольких тканях организма и быть связанным со строго определенным звеном метаболизма.
Для аллостерических ферментов характерно явление кооперативности. Оно проявляется в том, что каталитические центры субъединиц взаимодействуют не автономно, а взаимосвязано. Взаимодействие с субстратом или эффектором одного из таких центров усиливает способность к взаимодействию остальных активных центров (положительная кооперативность). В некоторых случаях связывание одним активным центром субстрата понижает способность к связыванию остальных центров (отрицательная кооперативность).
Наиболее хорошо положительная кооперативность изучена на примере молекулы гемоглобина, которая имеет четыре связывающих 0 2 участка (группы гема). Связывание молекулы кислорода одним центром, приводит к усиленному взаимодействию с кислородом остальных участков. Сродство гемоглобина к 0 2 к последней (четвертой) группе более чем в 100 раз больше, чем к первой. Так как связывающие кислород участки разделены в молекуле большими расстояниями, то они не могут взаимодействовать непосредственно. Очевидно, при оксигенировании меняется конформация молекулы в целом, что приводит к изменению сродства связывающих участков.
Кооперативность также является одним из путей регуляции активности ферментов.
Активность фермента может изменяться и в результате, так называемой ковалентной (посттрансляционной) модификации, при которой происходит или отщепление части молекулы или присоединение к ферменту небольших групп. В обоих случаях эти модификации молекулы фермента связаны с разрывом или образованием ковалентных связей.
Известно, что протеолитические ферменты желудочно-кишечного тракта (пепсин, трипсин, химотрипсин) синтезируются в виде неактивных предшественников - проферментов. Регуляция активности фермента в этом случае заключается в том, что под действием специфических веществ (ферментов) неактивная форма превращается в активную. Так, например, трипсин синтезируется в поджелудочной железе в виде трипсиногена, который, попадая в тонкий кишечник, под действием фермента энтерокиназы превращается в трипсин. При этом от трипсиногена отщепляется гексапептид. Трипсин в свою очередь разрывает одну пептидную связь в химотрипсиногене, что приводит к структурным изменениям в активном центре и превращает его в активный химотрипсин.
Превращение пепсиногена в активную форму пепсин также связано с отщеплением пептида от молекулы неактивного пепсиногена. Синтез протеолитических ферментов в виде проферментов имеет важное значение в процессе регулирования процесса пищеварения в желудочно-кишечном тракте.
Регулирование активности протеолитических ферментов в желудочно-кишечном тракте происходит не только превращением профермента в активный фермент, но и путем связывания ферментов с естественными ингибиторами. В слизистой оболочке желудка и кишечника были найдены низкомолекулярные белки, ингибирующие действие пепсина и трипсина. Весьма активный ингибитор пепсина был выделен из желудка свиньи, а ингибитор трипсина из поджелудочной железы.
Ковалентная модификация фермента с изменением его активности может происходить не только в результате разрыва пептидных связей, а путем присоединения к молекуле фермента специфической группы. Например, регуляция активности фермента гликогенсинтетазы, играющего основную роль в тонкой регуляции синтеза гликогена осуществляется путем фосфорилирования и дефосфорилирования его.
Фосфорилирование с участием протеинкиназ является распространенной формой регуляции активности ферментов путем ковалентной модификации. Активность большого числа ферментов и интенсивность соответствующих процессов обмена веществ определяется соотношением фосфорилированных и дефосфо - рилированных форм этих ферментов.
Регуляция ферментативной активности может осуществляться за счет усиления синтеза уже имеющихся ферментов или даже новых ферментов в ответ на изменившиеся условия существования (появление новых пищевых факторов, химических веществ).
При воздействии специфических веществ «индукторов» или «репрессоров» происходит соответственно инициация или подавление процесса транскрипции. Эта регуляция, осуществляемая в процессе биосинтеза фермента, может приводить к изменению концентрации фермента, изменению типов имеющихся в клетке ферментов и изоферментного состава.
Этот путь регуляции более медленный, так как связан с изменением биосинтеза белка. Поэтому между сигналом о необходимости изменения концентрации фермента и установлением его нового содержания пройдет определенное время - от нескольких часов, до нескольких дней. Следовательно, путем изменения концентрации фермента, быстрого регулирования скоростей реакций добиться нельзя. Однако, в тех случаях, когда необходимо не быстрое изменение метаболизма, а продолжительная регуляция метаболического процесса этот путь приобретает важное значение.
Например, в случаях необходимости стимуляции глюконеогенеза происходит повышение концентрации таких ферментов как глюкозо - 6 - фосфатаза, фруктозо -1,6 - бисфосфатаза и фосфоенолпируваткарбоксилаза. Потребность в повышенных количествах этих ферментов обусловлена тем, что они катализируют реакции в обход физиологически необратимых этапов прямого цикла.
Показано, что при метаболическом ацидозе у животных усиливается синтез глутаминазы. Это связано с необходимостью нейтрализации аммиаком накапливающихся в организме кислых продуктов.
Имеющиеся в литературе данные говорят о том, что индукция или репрессия ферментов могут вызываться диэтическими факторами.
Введение глюкозы крысам, предварительно голодавшим в течение 5 дней, вызвало резкое повышение активности глюкокиназы. Так как инъекция пуромицина или актимицина Д подавляли эту активацию, был сделан вывод о том, что причина повышения активности фермента объясняется увеличением его синтеза (пуромицин тормозит синтез белка, а актиномицин - синтез мРНК).
Хорошо известна зависимость между активностью ферментов цикла мочевинообразования и количеством белка в рационе. Повышение содержания белка в рационе сопровождается повышением активности этих ферментов, причем это повышение пропорционально интенсивности синтеза мочевины. Не было обнаружено изменения кинетических свойств ферментативных молекул, наличие каких-либо ингибиторов или активаторов, что позволило сделать заключение, что увеличение активности связано с повышеным синтезом соответствующих ферментов.
Велико значение индукции ферментов при патологии. Индукция ферментов часто сопряжена с развитием защитных процессов при возникновении патологических состояний организма. В то же время следует иметь в виду, что в некоторых случаях усиленный синтез ферментов в ответ на изменение внешних условий среды может привести к развитию патологического процесса.
В ряде случаев при поступлении в организм лекарственных или других чуждых ему веществ также происходит индукция ферментов. Однако это не всегда способствует адаптации организма к новому для него веществу и не всегда обеспечивает более благоприятные условия для жизнедеятельности организма, так как продукт ферментативного превращения может быть более токсичен, чем исходное вещество. В этом случае эффект будет отрицательный.
Способностью индуцировать образование ферментов, как установлено, обладают многие лекарственные вещества - барбитураты, летучие анастетики, гипогликемические вещества, анальгетики, инсектициды и др. Этим явлением можно объяснить наблюдающиеся часто привыкание к некоторым лекарственным веществам при их длительном применении.
Например, при экспериментальном введении собакам фенилбутазона у животных повышалось его содержание в крови и наблюдалось явление интоксикации. Повторное введение этого препарата уже не вызывало столь резко выраженного повышения его в крови и токсического эффекта.
Индукция ферментов фармакологическими веществами часто не является узкоспецифической. Часто образуются ферменты, способствующие превращению не только данного вещества - индуктора, но некоторых других лекарственных веществ. Например, введение в организм пентабарбитурата приводит к усилению метаболизма не только этого вещества, но вызывает усиленное окисление и гексабарбитурата и даже веществ, не относящихся к группе барбитуратов.
Говоря о метаболизме лекарственных веществ в организме нужно иметь в виду, что он может осуществляться не только за счет индукции ферментов, но также путем аллостерической и ковалентной модификации ферментов.
Принципы клинической энзимодиагностики
Регуляция ферментативной активности - не менее важный для успешного функционирования клетки процесс, чем регуляция экспрессии генов на уровне транскрипции. Существование этих механизмов позволяет клеткам и всему организму четко координировать осуществление многочисленных разветвленных метаболических реакций, обеспечивая наиболее высокий и экономный уровень обмена веществ, а также быструю приспособляемость к меняющимся условиям окружающей среды. При этом регуляция синтеза ферментов является более медленным механизмом, действующим в течение многих минут или даже часов, в то время как изменение ферментативной активности происходит мгновенно и действует в течение нескольких минут или секунд. Регуляцию активности ферментов можно назвать «тонкой настройкой» клеточного метаболизма.
Регуляция ферментативной активности может осуществляться несколькими путями, среди которых наиболее распространены аллостерическая регуляция и ковалентная модификация .
Аллостерической регуляции подвержены не все ферменты, а лишь те, которые имеют в составе молекулы аллостерический (от греч. аллос – другой и стереос – тело, пространство) центр - участок, отличающийся от активного центра, характеризующийся высоким сродством к регуляторным молекулам.
Подобные ферменты называют аллостерическими. Их активность регулируется при участии низкомолекулярных веществ (эффекторов ), общим свойством которых является способность к взаимодействию с аллостерическим центром, что приводит к искажению конформации белковой молекулы. Это искажение передается активному центру, в результате чего меняются активность фермента и скорость соответствующей реакции.
Эффекторы могут выполнять роль как ингибиторов активности ферментов, так и их активаторов. Примером ингибирования ферментативной активности может служить снижение активности первого фермента пути биосинтеза триптофана у E.coli - антранилатсинтетазы при избытке в клетке триптофана. В данном случае триптофан, как конечный продукт названного биосинтетического пути, служит игибитором активности ключевого фермента, что координирует скорость синтеза этой аминокислоты и позволяет клетке экономить свои ресурсы. Ведь при избытке триптофана, например, когда он присутствует в ростовой среде, клетке незачем расходовать строительные блоки и энергию на его синтез, она может воспользоваться экзогенной аминокислотой. Действительно, экспериментально доказано, что в процессе роста бактерии преимущественно используют добавленные к ростовой среде аминокислоты, пурины и пиримидины и что эти соединения оказывают ингибирующее действие на свой собственный синтез из молекул-предшественников. Поскольку в приведенном случае триптофан является конечным продуктом биосинтетического пути, скорость которого снижается при ингибировании ключевого фермента, такой тип регуляции носит название «ретроингибирование ».
Увеличение активности аллостерического фермента при связывании с эффектором (активатором) можно рассмотреть на примере аспартаттранскарбамоилазы (АТКазы), которая катализирует первую реакцию биосинтеза пиримидинов. Этот фермент активируется аденозинтрифосфатом (АТР) -пуриновым нуклеотидом. Следует отметить, что одновременно АТКаза ингибируется одним из конечных продуктов названного биосинтетического пути - цитидинтрифосфатом (СТР), причем активатор и ингибитор связываются с одним и тем же аллостерическим центром. Таким образом, с помощью регуляции активности одного фермента обеспечивается координация синтеза пуриновых и пиримидиновых нуклеотидов.
Мутационное повреждение аллостерического центра может обусловить утрату способности фермента связывать молекулы эффекторов и изменять в ответ на это свою активность. Данное явление используется в селекции микроорганизмов для получения мутантов с десенсибилизированными ферментами. Такие микроорганизмы часто являются продуцентами биологически активных веществ, и для их отбора используют аналоги метаболитов. Например, 5-метилтриптофан так же, как триптофан, способен ингибировать активность антранилатсинтетазы, но не заменяет триптофан в составе белка. Поэтому бактерии E.coli не способны формировать колонии на синтетической среде с этим веществом. Однако известны мутанты E.coli, растущие на среде с 5-метилтриптофаном. Эти бактерии содержат в клетках нечувствительную к ретроингибированию (десенсибилизированную) антранилатсинтетазу и синтезируют триптофан в избыточных количествах, выделяя его во внешнюю среду.
Еще одним распространенным путем регуляции активности ферментов служит ковалентная модификация - присоединение или отщепление от фермента небольшой химической группы. С помощью таких модификаций обычно либо полностью неактивная форма фермента становится активной, либо, наоборот, полностью активный фермент инактивируется. К явлению ковалентной модификации относятся: ограниченный протеолиз (укорочение полипептидных цепей), фосфорилирование - дефосфорилирование, аденилирование - деаденилирование, ацетилирование-деацетилирование и др. Например, гликогенсинтетаза клеток млекопитающих, катализирующая превращение глюкозы в гликоген, инактивируется после ковалентного присоединения фосфатной группы к боковой цепи одного из сериновых остатков и снова активируется при отщеплении фосфата. Другие примеры ковалентной модификации ферментов описаны в главе 3.
Особый случай регуляции активности ферментов представляют собой белок-белковые взаимодействия, в которых роль ингибиторов ферментов выполняют особые белки. При таких взаимодействиях блокируется активный центр фермента. Особое значение ингибирование с помощью белков имеет для регуляции активности протеиназ, участвующих в посттрансляционной модификации белков. Это способствует изменению скорости созревания многих важных для клетки белков, а следовательно, и интенсивности процессов, в которых последние принимают участие.
Глава 7. КОФАКТОРЫ
В ряде случаев для осуществления катализа ферменты нуждаются в особых посредниках - кофакторах. Кофакторы представляют собой вещества небелковой природы, которые функционируют на промежуточных стадиях ферментативной реакции (или цикла реакций), но не расходуются в ходе катализа. В подавляющем большинстве случаев кофакторы регенерируются в неизменном виде по завершении каталитического акта.
Разнообразные по химической природе кофакторы можно разделить на две основные группы: коферменты (слабо связаны с ферментом и при катализе отделяются от него) и простетические группы (прочно связаны с ферментной молекулой).
Основные механизмы, согласно которым кофакторы принимают участие в катализе, следующие:
Выполняют функцию переносчиков между ферментами. Взаимодействуя с одним ферментом, переносчик акцептирует часть субстрата, мигрирует к другому ферменту и передает переносимую часть субстрату второго фермента, после чего высвобождается. Такой механизм типичен для большинства коферментов;
Выполняют роль «внутриферментного» переносчика, что характерно, в первую очередь, для простетических групп. Простетическая группа присоединяет часть молекулы субстрата и переносит ее на второй субстрат, связанный в активном центре того же фермента. В данном случае можно рассматривать простетическую группу как часть каталитического участка фермента;
Изменяют конформацию ферментной молекулы, взаимодействуя с ней вне активного центра, что может индуцировать переход активного центра в каталитически активную конфигурацию;
Стабилизируют конформацию фермента, способствующую каталитически активному состоянию;
Выполняют функцию матрицы. Например, полимеразы нуклеиновых кислот нуждаются в «программе» - матрице, по которой строится новая молекула;
Играют роль промежуточных соединений. Иногда фермент может использовать в реакции молекулу кофактора, образуя из нее продукт, но при этом одновременно за счет субстрата образовать новую молекулу кофактора.
Среди известных в настоящее время ферментов примерно 40% способны осуществить катализ только при посредстве кофакторов. Наибольшее распространение имеют кофакторы, осуществляющие перенос восстановительных эквивалентов, фосфатных, ацильных и карбоксильных групп.